Etablering og utvikling av medisinsk metodevurdering i Norge – hvorfor og hvordan?
Michael 2012;9: 95–108
Formelle tiltak for å bedre kvaliteten i helsevesenet startet i USA på 1970 tallet, og ble diskutert og videreført i europeiske land. Viktig for utviklingen av metodevurderinger internasjonalt, så vel som i Norge, var Office of technology assessment (OTA). OTA fremskaffet dokumentasjon på effekt og sikkerhet ved ny medisinsk teknologi for den amerikanske kongressen. OTAs arbeidsform ble tatt opp ved sentre for Health Technology Assessment, (HTA) i flere land, først og fremst i England, Sverige og Nederland.
Sosial- og helsedepartementet etablerte et nasjonalt «Senter for medisinsk metodevurdering, SMM» i 1997/98, og SMM kunne dermed benytte andre lands erfaringer for sitt arbeid. SMM var organisert ved den uavhengige forskningsstiftelsen SINTEF i perioden 1998–2004. Da ble senteret fusjonert inn i Nasjonalt kunnskapssenter for helsetjenesten. SMM utarbeidet over 30 metodevurderinger i sin først periode, ca halvparten på oppdrag fra departement og direktorat. I Kunnskapssenteret er arbeidet med metodevurderinger blitt styrket og utvidet.
Internasjonale erfaringer
Arbeid med å heve kvaliteten innen medisinsk behandling og teknologi begynte formelt fra ca 1970, først med Office of technology assessment (OTA)‘s arbeid i USA. OTAs helseavdeling (OTAH) fremskaffet dokumentasjon på effekt og sikkerhet ved ny medisinsk teknologi for den amerikanske kongressen (1). Samtidig utarbeidet Avedis Donebedian (2) et detaljert program for hvordan kvalitetssikring skulle gå til, primært basert på legers og andres medarbeideres profesjonelle standard. Systemkravene, som fikk utbredt anvendelse, var først og fremst til for å sikre at institusjoner som oppfylte formelle legale krav kunne få dekning for sine tjenester via statens Medicare og Medicaid system.
Systemutviklingen i USA førte til utarbeidelsen av et akkrediteringsprogram, dvs institusjoner kunne søke om en formell godkjenning som måtte fornyes med regelmessige mellomrom. Akkrediteringen sikret at ansatte og nyansatte hadde den riktige formelle bakgrunn. Akkreditering ble et kvalitetsstempel for institusjonen og ca 80 % av de amerikanske sykhusene er i dag akkrediterte.
Utviklingen i USA ble fulgt nøye i Europa, først og fremst England, Nederland og Sverige. I England ble akkrediteringsvirksomheten sentrert rundt fageksperters/kollegers inspeksjon – peer reviews – av andre institusjoner basert på detaljerte målsetninger for det som måtte anses som god kvalitet. Inspeksjonene munnet ut i dokumenter som ga råd om områder som kunne og burde forbedres. Alle de nordiske land fulgte også tidlig med på arbeidet med kvalitetsstandarder og akkrediteringssystemer, men ingen gikk så langt som USA, og delvis England, med detaljert kontroll og godkjenningsordninger.
En europeisk videreføring av OTA(H) programmet i USA skjedde samtidig i Nederland (1) og ved HTA- (Health Technology Assessment)-programmet i England som ble finansiert fra helsedepartementets FOU-direktorat, og fikk stor betydning også for internasjonalt HTA-arbeid. Det fastslo bla at HTA skulle omfatte informasjon fra forskning om klinisk nytte, kostnadseffektivitet og andre aspekter ved medisinske metoder. Med metoder («health technologies») i denne sammenheng menes alle prosedyrer og tiltak som brukes i helsetjenesten for å forebygge, diagnostisere og behandle sykdom, inkludert pleie og rehabilitering.
Sverige dannet allerede i 1988 SBU (Statens beredning för medicinsk utvärdering) som en frittstående, men statlig finansiert organisasjon som utarbeidet faglig baserte vurderinger av medisinske metoder. Vurderingene skulle baseres på vitenskapelige data om metodens effekt, samt «beprøvad erfarenhet». Man så altså ikke formell medisinsk vitenskap som den eneste kunnskapskilden, men denne ble vurdert av relevant klinisk ekspertise. En tilsvarende arbeidsform lå også til grunn for sentre i Spania, Frankrike og Canada. Senere har svært mange land kommet til. Ved HTA international’s årskonferanse i 2011 var det som eksempel deltagere fra 50 ulike land.
Internasjonal statistikk ble tidlig en viktig kilde til kunnskapsinnhenting i medisin. Dette var først og fremst knyttet til det internasjonale Cochranesamarbeidet (etter den engelske statistikeren Archie Cochrane). Ved en Cochrane-studie sammenliknes ofte de statistiske resultatene fra likeartede studier og resultatene samkjøres i en felles analyse (meta-analyse). Det viser seg da ofte at en studie med et gunstig utfall kan ha paralleller med ikke så gunstig eller null effekt, og konklusjonene blir mer usikre enn man kanskje antok. Det ble etablert Cochrane-sentre i flere land og regioner, det nordiske senteret ble lagt til København, og en norsk gren av dette til Folkehelseinstituttet i Norge.
Internasjonale konferanser om kvalitet i helsetjenesten har vært standard siden 1980–90, fremst gjennom ISQua (International Society of Quality in Health Care), Cochrane Collaboration og ISTACH (International Society of Technology Assessment in Health Care, senere HTAinternational).
De fleste HTA-sentre er dessuten medlemmer av den internasjonale foreningen International Network on Agiencies for Health Technology Assessment (INAHTA), som ble etablert i 1993 av de opprinnelige 5 land med HTA-sentre, nå har INAHTA 53 non-profit medlemsorganisasjoner fra 29 land. Både HTAi og INAHTA har undergrupper som arbeider med etikk, metodeutvikling, undervisning, industrisamarbeid osv.
Nasjonal bakgrunn
Det Norske Veritas var tidlig interessert i kvalitetsoppføging av medisinsk apparatur og ville gjennomføre en nasjonal godkjenningsordning etter sine egne erfaringer fra skipsbygging. Et pilotprosjekt ble gjennomført i Trondheim, men prosjektet fikk ingen videre oppfølging.
Norsk instutt for sykehusforskning (NIS) viste også interesse for temaet medisinsk kvalitetssikring og medvirket aktivt med publikasjoner (3) og ved nordiske konferanser. NIS samarbeidet på 1980-tallet med de nordiske sykehusforskningsinstituttene om evalueringer av enkelte nye medisinske teknologier, som MR. Det ble videre dannet et Norsk Forum for kvalitet i helsetjenesten (NFKH) som arrangerte metodekurs og en nasjonal konferanse.
Rådet for medisinsk forskning (RMF) ved NAVF tok i 1980 initiativ til en utredning gjennomført for å beskrive status og utviklingstrender innen alle de kliniske fagfelt som er viktige i sykehus, («Medisinsk forskning og teknologi – utvikling og konsekvenser») (4). Rapporten inneholdt mange interessante momenter uten at en kan påpeke større praktiske konsekvenser.
Omtrent samtidig startet RMF et program med konsensuskonferanser (4). Det innebar at en serie foredragsholdere skulle belyse et klinisk interessant problemområde, og at et utnevnt panel etterpå skulle komme med en rettledende anbefaling. Den første konsensuskonferansen dreide seg om mammografi for kvinner i 50–70 årsalderen. Et oppsiktsvekkende resultat var at panelet ikke kunne anbefale mammografi fordi mulighetene for feiltakelser var for store og at antallet sant positive funn var for lite. Fortsatt er dette et tema med stor usikkerhet og uenighet. På tross av dette er mammografi gjennomført i alle de nordiske land.* Forskningsrådets siste konsensuskonferanse ble holdt i 2011 om heroinbehandling av rusmisbrukere. I tråd med utviklingen ble nå en medisinsk metodevurdering av dette tiltaket lagt frem som diskusjonsgrunnlag.
Helsedirektoratet senere Helsetilsynet var tidlig opptatt av kvalitetssikring i helsetjenesten og fikk utarbeidet flere utredninger (5, 6) hvor den siste tok opp temaet med uheldige hendelser som grunnlag for kvalitetsforbedring. Det ble opprettet et landsomfattende meldesystem basert på en felles rapporteringsmal, og resultatene ble oppsummert i årlige publikasjoner. Slike negative hendelser kunne brukes til internt forbedringsarbeid. Med bakgrunn i målsettingen om læring og forbedring, er denne aktiviteten nå lagt til Kunnskapssenteret.
Kvalitetssikring omfattet etterhvert et eget sett av verktøy og metoder som skulle optimalisere forholdene for arbeidet i sykehusene. Helsedirektoratet hadde også tilknyttet Fagrådet for høyteknologisk medisin, som sammen med Statens sykehusråd ga innspill på bruk av ulike nye metoder i helsevesenet.
Folkehelseinstituttet med helsetjenesteforskning og Cochrane Collaboration En gruppe helsetjenesteforskere ved Folkehelseinstituttet startet norske aktiviteter knyttet til Cochrane Collaboration på 1990-tallet. De ytet en stor innsats i å støtte opp om den internasjonale målsetting å etablere en database med systematiske oversikter over effekt av intervensjoner, og ga undervisning i utarbeidelse av slike oversikter.
Sosial- og helsedepartementet (SHD) viste tidlig interesse for kvalitetsutvikling og avsatte penger som kunne brukes til ulike forbedrings- og utviklingsprosjekter. Sykehusene fikk pålegg om å ansette kvalitetsrådgivere.
Departementet nedsatte i 1996 en arbeidsgruppe for å forberede et nasjonalt senter for teknologivurdering basert på de svenske og engelske erfaringene. Det ble utarbeidet en rapport «Et helhetlig system for nyttevurdering av medisinsk praksis» (7) som beskrev et system for metodevurderinger, inkludert økonomiske, organisatoriske og etiske analyser. Rapporten drøftet flere muligheter for plassering av senteret, bl a universitetet, Rikshospitalet, Helsedirektoratet og Folkehelseinstituttet, sistnevnte pga deres Cochranesamarbeid. En viktig forutsetning var uavhengighet fra statlige institusjoner som kunne påvirke innholdet og konklusjonen i evt utredninger hvis de ikke stemte med det som var vedtatt i nasjonale helseplaner. Etter kontakt mellom helseministeren og lederen for SINTEF Unimed ble det bestemt at SINTEF som en uavhengig, frittstående forskningsstiftelse kunne påta seg å etablere senteret. Lokalisering ble ved SINTEFs lokaler på Vindern i Oslo. Organisasjonen fikk navnet Senter for medisinsk metodevurdering (SMM).
Etablering av Senter for medisinsk metodevurdering (SMM)
SMM ble etablert høsten 1997 med bakgrunn i budsjettproposisjonen (St. prp. nr. 1) hvor følgende fire oppgaver ble skissert:
1. Identifikasjon av metoder
2. Fremskaffelse av resultatdata
3. Syntese av eksisterende dokumentasjon
4. Spredning og implementering av resultater
Det ble inngått en avtale mellom SHD og SINTEF Unimed om et treårig prosjekt som så skulle evalueres. Høsten 1997 ble de to første medarbeidere tilsatt; direktør og informasjonsmedarbeider, og våren 1998 tilkom tre medisinske fagkonsulenter og en sekretær. SINTEF var et godt sted å være for en nystartet virksomhet, selv om denne aktiviteten var annerledes enn den oppdragsvirksomhet SINTEF var vant til. SINTEF Unimeds ledelse lot SMM styre seg selv, men var positivt interessert og fulgte opp ved behov.
Organisering
En organisatorisk oppbygging av senteret og dets styreform ble utformet, jf figur 1. Det var viktig for SMM å ha en uavhengig, faglig sterk styringsgruppe, og en referansegruppe med bakgrunn i senterets viktigste samarbeidspartnere, begge oppnevnt av SHD. Kanskje enda viktigere ble at senteret fikk legitimitet hos fagmiljøene i helsevesenet, som en forutsetning for at metodevurderinger skulle fungere. Metodevurderingene ble utført etter internasjonalt anerkjente føringer for systematiske oversikter og HTA (8) hvor all relevant dokumentasjon om en gitt metode blir identifisert og vurdert etter gitte kriterier for studiedesign, kvalitet og validitet, før en samlet syntese av metodens nytte. Prosessen skulle være åpen og reproduserbar. I tillegg belyses relevant verdigrunnlag, sosiale, organisatoriske og økonomiske konsekvenser (figur 2).
SMM ønsket fra starten å involvere nasjonale faglige ekspertisegrupper i alle utredninger. Det lå flere grunner bak dette ønsket:
norske fagekspertise ble trukket inn i prosessen, og kunne dermed bidra til god forankring og implementering av konklusjonene i sine miljøer,
norske fagfolk fikk innføring i systematisk granskning av litteratur og metodevurdering på egne fagfelt,
ekspertgruppen bisto SMM i å bruke ferdigstilte internasjonale metodevurderinger og systematiske oversikter, og sette disse inn i en norsk kontekst.
Deltagelse i SMMs ekspertgrupper ble etter hvert godkjent som del av obligatorisk spesialistutdanning, bla i allmennmedisin. I tillegg til de spesifikke ekspertgrupper opprettet for hver metode, etablerte SMM et bredt faglig nettverk på 50–60 medlemmer som dekket de fleste områder i helsevesenet, og som senteret kunne konsultere, bl.a. om behov for nye utredninger (figur 1).
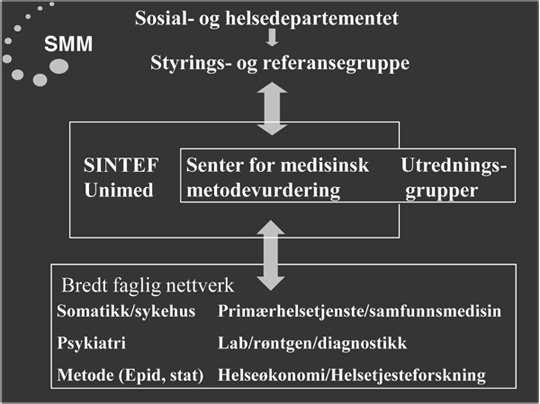
Figur 1. Organisering av SMM (1998–2004)
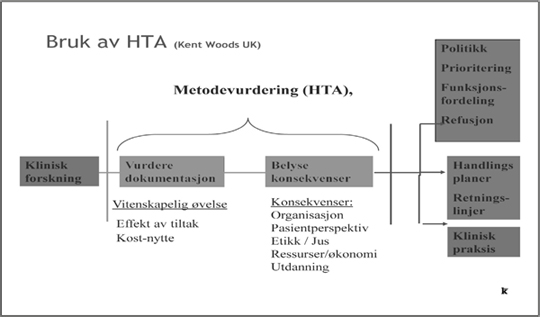
Figur 2. Utarbeidelse og bruk av metodevurderinger, fritt etter Kent Woods, UK.
Internasjonalt samarbeid
HTA ble etablert i mange vestlige land på 90-tallet (9, 10). En felles bakgrunn var den store økning i medisinske tilbud, med potensielle økte kostnader for helsetjenesten og en samtidig flom av informasjon hvor det var vanskelig å skille ut de beste grunnlag for helsepolitiske og kliniske beslutninger. Hovedmålsettingen for HTA var å øke kvaliteten på tilbudene ved at det ble stilt krav til dokumentasjon på god, effektiv og forsvarlig behandling. Samtidig med den interne strukturoppbygging tok SMM initiativ til å delta i det internasjonale samarbeidet. SMM ble institusjonelt medlem i ISTAHC, INAHTA og Euroscan. Dette åpnet for mer uformelle kontakter med viktige HTA-sentre (SBU, Englands HTA-miljøer) og deltagelse i EUprogrammer for medisinsk metodevurdering (10). Kanskje aller viktigst ble samarbeidet med de nordiske metodevurderingsorganisasjonene. Man så et klart behov for å utnytte hverandres arbeid, og unngå dobbeltarbeid. Et konkret nordisk samarbeid om felles utredning startet allerede i 1998 («Hearing Loss in the Elderly») der man i tillegg til en «vanlig» metodevurdering om effekt av tiltak, kunne påvise store forskjeller mellom landenes etablerte praksis.
Metodevurderinger
Det var SHD som hadde initiert og etablert SMM. De første forespørsler om konkrete metodevurderinger kom derfor naturlig nok også fra departementet: «Effekt av telemedisin i pasientbehandling», «Diagnosekriterier for nakkeslengskader», «Behandling av akutt skiveprolaps», «Prostatakreftscreening». Det var ikke de enkleste problemstillinger, men viste kanskje at departementet hadde tiltro til etableringen av senteret! Og spørsmålene falt innenfor de kriterier senteret hadde satt for sine valg av problemstillinger:
Uenighet om metodevalg – variasjon i praksis
Usikker klinisk effekt
Angår mange pasienter
Ressursbruk
Stor allmenn interesse
Det finnes dokumentasjon (selv om det også er viktig å påpeke at dette mangler)
Temaets viktighet ut fra høy sykelighet/dødelighet
I tillegg til SHD ble styrings- og referansegruppen og fagpanelet viktige forslagsstillere for SMM.
Informasjon
Som nevnt var informasjonsmedarbeideren en av de første ansatte i SMM. Det avspeilet at informasjon var en viktig utfordring for senteret. Det ble utarbeidet en egen visuell profil for rapporter (med lett gjenkjennelig sennepsgul farge og blå logo!), informasjonsmateriell, websider osv. Men viktigst var personlige møter og kontakter:
En egen konferanse markerte innføring av metodevurdering i Norge, og ble åpnet av helseministeren i nærvær av internasjonale og nasjonale fagfolk fra helsetjeneste og forvaltning. Egne faglige seminarer presenterte alle ferdigstilte metodevurderinger for relevante målgrupper. Senterets ansatte og styringsgruppe viste stort engasjement i å presentere aktiviteten i møter med mulige samarbeidspartnere og målgrupper (Helsetilsynet, Legeforeningen, Forskningsrådet, SLV, Kreftforeningen).
Videre utvikling av SMM
Evaluering
SMM som prosjekt skulle evalueres etter 3 år. Evalueringen inkludert en egen brukerundersøkelse, ble gjennomført i 2001 (11). Brukerundersøkelsen viste at det var et klart behov for et senter for medisinsk metodevurdering i Norge, men også at kjennskapen til senteret var ulikt fordelt; størst blant den sentrale helseforvaltning og ledende kliniske miljøer. Tilbakemeldingen fra deltagere i ekspertgrupper var positiv. Det ble oppfattet som meget nyttig oppdatering og opplæring i eget fagfelt (12). Selv om prosessen var tidkrevende sa alle seg villige til å delta i evt. oppdatering av rapportene. Evalueringen konkluderte med at SMM hadde gitt uavhengige og faglig forankrede vurderinger av god kvalitet som var implementert hos mottagerne, selv om SMM ikke hadde noen formalisert rådgiverfunksjon. Evalueringen anbefalte SMM å legge mer vekt på å nå det kliniske «grunnfjellet» (bla allmennlegene) og kommunale helsemyndigheter. Evalueringen påpekte også en viss oppsplitting i Norge i små miljøer med beslektede aktiviteter, jf Cochrane-virksomheten på Folkehelseinstituttet.
Totalt antall utredninger, og ble de brukt?
SMM produserte i alt 31 metodevurderinger i løpet av 6 års virksomhet (tabell 1) (12). Ca halvparten var initiert av forespørsler fra SHD eller Helsedirektoratet som ønsket et faktagrunnlag for «vanskelige» beslutninger, som screeningproblematikk, innkjøp av kostbart utstyr og funksjonsfordelinger, eller fra det faglige nettverket eller styringsgruppen (12).
SMM-Rapport 98–01 |
Medisinsk metodevurdering – en orientering |
SMM-Rapport 98–02 |
Telemedisin |
SMM-Rapport 99–02 |
Behandling av hjerneslag med trombolyse |
SMM-Rapport 99–03 |
Screening for prostatakreft |
SMM-Rapport 99–04 |
Osteoporose – diagnostikk forebyggelse og behandling |
SMM-Rapport 00–01 |
Genterapi – status og fremtidige muligheter innen klinisk medisin |
SMM-Rapport 00–02 |
Preoperativ hårfjerning |
SMM-Rapport 00–03 |
Fotodynamisk terapi ved aldersrelatert maculadegenerasjon |
SMM-Rapport 00–04 |
Hjemmeblodtrykksmåling |
SMM-Rapport 00–05 |
Nakkeslengskade – diagnostikk og evaluering |
SMM-Rapport 00–06 |
Hjertelaserbehandling |
SMM-Rapport 00–07 |
Gene therapy – status and potential in clinical medicine |
SMM-Rapport 00–08 |
Positronemisjonstomografi (PET) – diagnostisk og klinisk nytteverdi |
SMM-Rapport 01–00 |
Hørselsreduksjon hos voksne |
SMM-Rapport 01–01 |
Lumbalt skiveprolaps med rotaffeksjon. Behandlingsformer |
SMM-Rapport 01–02 |
Pasientvolum og behandlingskvalitet |
SMM-Rapport 01–03 |
Screening for kolorektal kreft. Konferanserapport |
SMM-Rapport 01–04 |
Diagnostikk med ultralyd i primærhelsetjenesten |
SMM-Rapport 01–05 |
Ventilasjon i operasjonsstuer |
SMM-Rapport 01–06 |
Transkraniell magnetisk stimulering (TMS) ved depresjon |
SMM-Rapport 02–02 |
Brakyterapi ved prostatakreft |
SMM-Rapport 02–03 |
Barn født etter intracytoplasmatisk spermieinjeksjon |
SMM-Rapport 02–04 |
Screening for brystkreft |
SMM-Rapport 02–05 |
PCI ved akutt hjerteinfarkt |
SMM-Rapport 02–06 |
Valg av implantater ved innsetting av primær total hofteprotese |
SMM-Rapport 03–01 |
Kirurgisk behandling av ekstrem/sykelig fedme |
SMM-Rapport 03–02 |
Østrogenbehandling for klimakterielt besvær – er det trygt etter brystkreft? |
SMM-Rapport 03–03 |
Fødsel av barn i seteleie til termin |
SMM-Rapport 03–04 |
Terapeutisk bruk av hematopoietiske stamceller fra navlestrengsblod |
SMM-Rapport 03–05 |
Primær behandling av ovarialcancer |
SMM-Rapport 03–08 |
Positronemisjonstomografi (PET) – diagnostisk og klinisk nytteverdi |
SMM-Rapport 03–07 |
Grønn resept – effekt og kostnadseffektivitet |
SMM-Rapport 03–08 |
Bruk av palliativ kirurgi i behandlingen av kreftpasienter |
SMM-Rapport 03–09 |
Rengjøringsmetoder i operasjonsstuer |
SMM-Rapport 03–10 |
Profylaktisk fjerning av visdomstenner |
SMM-Rapport 03–11 |
Helsetjenester og gamle – hva er kunnskapsgrunnlaget |
Effekt i praksis |
Antall metodevurderinger |
|---|---|
Nasjonal praksis |
12 |
Nasjonale retningslinjer |
2 |
Funksjonsfordeling |
2 |
Kliniske retningslinjer |
4 |
Ingen behov for endring |
3 |
Ingen opplysning om effect |
7 |
Rådene er ikke fulgt |
1 |
De første utredningene fikk ulike anvendelser, noen gikk rett inn i beslutninger for helsevesenet («Bruk av hjertelaser»), andre omhandlet problemstillinger som fortsatt er aktuelle («Screening», «PET»). Det var SMMs inntrykk at nytten for beslutningstagere var mest uttalt der kunnskapsgrunnlaget var godt dokumentert med klare konklusjoner.
En spørreundersøkelse initiert av SMM i 2004 innhentet synspunkter på senterets rapporter. Ansatte i sentral helseforvaltning benyttet rapportene til informasjon i offentlige beslutninger. Flere av metodevurderingene ble ført videre i faglige retningslinjer (tabell 2). Alle hevdet at vurderingene hadde stor betydning i egen faglig oppdatering og diskusjon med kollegaer (12, 13).
I rapporten fra SHD’s arbeidsgruppe ved etableringen av SMM (7), ble det understreket at medisinsk metodevurdering måtte bygges inn i et formalisert helhetlig system for kontinuerlig vurdering av medisinske metoders bruk og nytte for helsevesenet. Systemet skulle bestå av en kontinuerlig prosess:
1. analyse av praksis (registre, indikatorer)
2. identifikasjon av problemer
3. relevante metodevurderinger
4. helsepolitiske beslutninger
5. monitorering av praksis
I sosialkomiteens merknad til Ot. prp. Nr. 66 (2000–2001) Lov om helseforetakene sto det: «Det er viktig at den kunnskap som frembringes gjennom medisinske metodevurderinger blir aktivt brukt av helsemyndigheter og helseforetak slik at effektive og virksomme helsetjenester kommer pasienten til gode. Like viktig er det at medisinske tiltak med liten eller ugunstig effekt blir faset ut.»
Initiativ til organisatorisk endring
Evalueringen av SMM hadde påpekt oppsplitting og lite felles utnyttelse av beslektede miljøer i Norge. Høsten 2002 ble det tatt uformelle initiativ fra enkeltpersoner til en mulig sammenslåing mellom SMM, Gruppe for helsetjeneste forskning på Folkehelseinstituttet og HELTEF (pasienterfaringsundersøkelser og kliniske indikatorer) ved Akershus universitetssykehus. Initiativet strandet da, men diskusjonen ble viktig i en senere prosess.
I 2004 skjedde en omorganisering av den sentrale helseforvaltning i Norge, med opprettelsen av et større Sosial- og helsedirektorat (SHdir). Departementet ønsket SMM innlemmet i dette direktoratet, sammen med Cochrane-aktivitetene på Folkehelseinstituttet. SMM protesterte ganske sterkt på dette, og ble klart støttet av viktige organisasjoner som Legeforeningen og universitetene. De understreket verdien av at SMM forble et uavhengig faglig organ som ikke kunne mistenkes for påvirkning fra noen parter. En innlemming i direktoratet ville ikke ivareta dette. Helseministeren ønsket å se nærmere på forslaget, men videreførte inntil videre SMMs plassering ved SINTEF.
En tanke var imidlertid sådd om en egen faglig enhet, utenom forvaltningen, som kunne omfatte så vel SMM som HELTEF og «Kunnskapsdivisjonen» i SHdir (tidligere Folkehelseinstituttets Cochrane miljø). Sommeren 2003 nedsatte lederen for SHdir en prosjektgruppe bestående av lederne for disse enhetene, med mandat til å skissere et nytt selvstendig senter, faglig uavhengig, men med klare forutsetninger å forsyne helsevesenet med gode beslutningsgrunnlag.
Resultatet ble at «Nasjonalt kunnskapssenter for helsetjenesten» ble etablert fra 1. januar 2004, et faglig uavhengig senter, som var etatstyrt fra SHdir (14).
Videreføring i Kunnskapssenteret
Kvantitativ og kvalitativ styrking av metodevurderingsvirksomheten
Selv om SMM hadde utvidet sin stab i løpet av de seks årene ved SINTEF, var det fremdeles en liten gruppe (12–14 personer). I Kunnskapssenteret fikk disse selskap av kunnskapsdivisjonen i SHdir, som til dels hadde laget «kunnskapsoppsummeringer» for SHdir, til dels arbeidet med Cochrane utredninger. Begge disse foregikk uten et system med eksterne ekspertgrupper som var SMMs arbeidsform. Forskjellig arbeidsform skapte til dels gjensidig skepsis, men bidro etter hvert også til faglig utvikling og styrking av metodevurderingene.
Klare bestillere
Etableringen av Kunnskapssenteret ga på mange vis det «system» rundt metodevurderingene som tidligere var etterlyst (7). Direktoratet var en hovedbestiller av vurderinger, men også de nye regionale helseforetakene representerte nye samarbeidspartnere. Det ble også skapt arenaer for samarbeid med SLV, profesjonsforeninger og friville organisasjoner om behov for metodevurderinger. Metodevurderinger fikk en formell plass i nasjonale retningslinjer, jf SHdirs arbeid med krefthandlingsplanene.
Nasjonalt råd for kvalitet og prioritering i helsetjenesten
Opprettelsen av dette rådet med sekretariat i Kunnskapssenteret forutsatte at diskusjoner i rådet skulle baseres på best mulig tilgjengelig kunnskap, og medisinske metodevurderinger har utgjort nyttige diskusjonsgrunnlag.
Diskusjon
Det ble innledningsvis skissert hvordan ulike formelle tiltak for å bedre kvaliteten i helsevesenet har pågått siden 1970–80 tallet. HTA/metodevurderinger var ett av disse tiltakene som har vist økende nytte og anvendelse internasjonalt.
HTA er blitt et etablert verktøy i utvikling av retningslinjer, innføring og finansiering av ny teknologi og utfasing av utdaterte metoder. Det er HTA-sentre i mange land, også i utviklingsland hvor det synes ekstra viktig at ressursene benyttes til godt dokumenterte tiltak. Norge har hatt meget stor nytte av den internasjonale utvikling, både på et helsepolitisk, overordnet plan, og på det mer konkrete metodologiske nivået hvor vi som et lite miljø har lært av dem som gikk foran oss. Etterhvert har vi imidlertid også kunnet delta på like fot.
Medisinske metodevurderinger er kommet for å bli i Norge. Og stadig flere får selv innsikt og erfaring i hvordan de utarbeides. Medisinsk metodevurdering i Norge fikk en god start i og med sin plassering i SINTEF som signaliserte et miljø uavhengig av medisinske «interesser». Samtidig var det nyttig med et skifte til en mer formell plass i et samlet system ved opprettelsen av Kunnskapssenteret.
Det er mange utfordringer i arbeidet med metodevurderinger. Men utfordringene representerer også forutsetninger for å lykkes. En metodevurdering må omfatte temaer som er sentrale for brukerne, og det krever at problemstillinger reises ut fra et korrekt bilde av norsk helsetjeneste. En metodevurdering fungerer best i et system hvor alle elementer som inngår i en beslutningsprosess er synlige, med definert ansvar.
I tillegg til de tre miljøene som utgjorde starten av Kunnskapssenteret, huser nå senteret et miljø for kvalitetsutvikling (GRUK), meldesystemer for uheldige hendelser, pasientsikkerhetskampanjen, sekretariatet for kvalitet og prioriteringsrådet, og ikke minst Helsebiblioteket. Forholdene bør ligge meget godt til rette for at metodevurderinger i Norge styrkes og finner ytterligere anvendelsesområder.
Litteratur
Banta HD, Luce BR. Health Care Technology and Its Assessment: An International Perspective. Oxford, England: Oxford University Press, 1993.
Donabedian A. The quality of medical care. Science 1984; 200: 856–64.
Backe B. Kvalitetssikring og kvalitetskontroll i institusjonshelsevesenet. Tidsskr Nor Legeforen 1985; 105: 1246–9.
Piene H, Backe B. Konsensuskonferanser – et hjelpemiddel for helsepolitiske prioriteringer. Kommunal Rapport 1989.
Helsedirektoratet. Utredning 4–91: Sikring av kvalitet i helsetjenesten. Oslo: Helsedirektoratet, 1991.
Piene H, Hegna E, Mork T. Kvalitetssikring basert på meldinger om skader og uhell. Tidsskr Nor Legeforen 1992; 112: 3212–5.
Sosial og helsedepartementet. Organisering av medisinsk teknologivurdering i Norge. Rapport. Oslo: Sosial- og helsedepartementet, 1996.
NHS Centre for Reviews and Dissemination. Undertaking systematic reviews of research on effectiveness. CRDs Guidance for those carrying out or commissioning reviews. CRD Report Number 4. 2nd ed. University of York, UK, 2001.
Banta D. What is technology assessment? Int J Technol Assess Health Care 2009; 25: Supplement 1: 7–8.
Jonsson E. Development of health technology assessment in Europe. A personal perspective. Int J Technol Assess Health Care 2005; 2: 171–183.
Brofoss KE, Søgnen R. Senter for medisinsk metodevurdering. En evaluering. NIFU Skriftserie nr. 3/2001.
Håheim LL, Mørland B. Health Technology Assessment: Development and Future. I: Dwivedi AN red. Handbook of Research on Information Technology Management and Clinical Data Administration in Healthcare. Hershey Penn: IGI Global, 2004.
Lund Håheim L, Mørland B, Wisløff T, Lyngstadås A. Six years’ experiences with interdisciplinary review teams in health technology assessment in Norway. Int J Technol Assess Health Care 2005; 21: 526–531.
Vedtekter for Kunnskapssenteret. http://www.kunnskapssenteret.no
berit.morland@kunnskapssenteret.no
Nasjonalt kunnskapssenter for helsetjenesten
Postboks 7004 St. Olavs plass
0130 Oslo
hroar.piene@comhem.se
Vidargatan 4,
113 27 Stockholm
Sverige
