15: Kost-effektanalyse i en randomisert kontrollert studie - status for Norge
Michael 2017; 14: Supplement 19, 188–200.
Kost-effektanalyser med utgangspunkt i et klinisk randomisert kontrollert forsøk (RCT) gir en unik mulighet til å evaluere pasientforløp med hensyn til både kostnader og helseeffekter. Resultatet fra en kost-effektanalyse, uttrykt ved kostnad per ekstra effekt, gir informasjon til beslutningstakere om et tiltak bør tas i bruk eller ikke. Status per i dag er at analyser av kostnader og helseeffekter i de fleste sammenhenger gjøres med utgangspunkt i matematiske modeller med data hentet fra flere kilder. Dette er viktige analyser vi bør fortsette med. I denne artikkelen retter vi derimot fokus på kost-effektanalyser i kjølvannet av en RCT. Vi mener denne typen analyser gjennomføres i for liten grad. Kost-effektanalyser krever ofte en relativt liten ekstrainnsats i en RCT som uansett skal gjennomføres. Vi gir i denne artikkelen en oversikt over hvordan kost-effektanalyser kan bli en naturlig del av en RCT, samt en oppsummering av publiserte kosteffektanalyser basert på norske RCT studier fram til oktober 2016.
Introduksjon
I beslutninger om innføring av ny teknologi har det siden vi fikk nasjonale retningslinjer for prioritering i helsetjenesten i innstillingene kalt «Lønning I» (1987) og «Lønning II» (1997), vært foreslått å inkludere kriteriene alvorlighet, klinisk effekt og at kostnadene skal stå i et rimelig forhold til effektene (1,2). Statens legemiddelverk (SLM) innførte, som første institusjon i Norge i 2007 et krav om at disse tre kriteriene skulle vurderes ved innføring av nye legemidler (3). Inntil nylig, var SLM fortsatt den eneste institusjonen som benyttet kriteriene eksplisitt i sine beslutninger av legemidler finansiert over Folketrygden. Det betyr at beslutninger om bruk av legemidler i institusjon (sykehus og sykehjem), medisinsk utstyr, nye kirurgiske prosedyrer eller organisasjonsendringer ikke har fulgt den samme systematiske vurderingen.
I den senere tid har fokuset på eksplisitte metoder for innføring av ny teknologi økt i andre deler av helsesektoren (4–7). Flere organisatoriske endringer er initiert for å sikre at beslutninger baseres på de samme prinsippene for hele helsesektoren. To viktige initiativ er Prioriteringsrådet og kunnskapsplattformen «Nye Metoder» (8, 9). Prioriteringsrådet jobber på mandat fra Helse og Omsorgsdepartementet og diskuterer ulike problemstillinger knyttet til prioritering i helse- og omsorgstjenesten. Disse problemstillingene kan være knyttet til prinsipper for prioritering (i hele tjenesten), ulik tilgang til helsetjenester, samhandlingsutfordringer og befolkningsrettede tiltak som screening og vaksinering (9). Gjennom «Nye Metoder « opprettet av Helsedirektoratet er fokuset knyttet til beslutninger om å innføre ny teknologi i spesialisthelsetjenesten. Beslutninger kan tas enten lokalt eller nasjonalt, avhengig av omfanget av den nye teknologien. Ved lokale beslutninger må helseforetaket selv utføre en mini-metodevurdering. Ved nasjonale beslutninger kreves det at SLM eller Nasjonalt folkehelseinstitutt (tidligere Kunnskapssenteret) utfører enten en hurtig-metodevurdering eller en fullstendig metodevurdering (8). De to sistnevnte inneholder, i tillegg til en vurdering av effekt og sikkerhet, også en vurdering av kostnader og organisering (som mini-metodevurdering), samt kostnadseffektivitet, budsjettkonsekvenser (hurtig-metodevurdering), etikk og jus (fullstendig metodevurdering) (8).
Alle kost-effektanalyser som blir gjennomført av SLM og Nasjonalt folkehelseinstitutt blir gjennomført ved hjelp av matematiske modeller, som beslutningstrær, Markov modeller og mikrosimuleringsmodeller (10,11). Fordeler med matematiske modeller er at flere ulike alternativer kan evalueres samtidig, muligheten for lengre tidsperspektiv og at data er samlet inn fra mange kilder. Dette medfører at generaliserbarheten blir god (10,11).
Selv om flere organisatoriske systemer i helsevesenet er implementert for en bredere vurdering av kostnadseffektivitet, mener vi at det i tillegg er et uutnyttet potensiale i kliniske RCTer. Det offentlige finansierer årlig en rekke randomiserte studier, både gjennom de regionale helseforetakene og gjennom andre finansieringskilder, som Norges Forskningsråd. Det å gjennomføre en RCT er ressurskrevende i form av innsats fra de som organiserer og gjennomfører studien. I tillegg er man er avhengig av at pasienter frivillig samtykker til å delta i studiene. Men, når en RCT er planlagt og skal gjennomføres, vil ekstrainnsatsen ved å legge til rette for en kost-effektanalyse være liten og vil gi verdifull informasjon om kostnader (12). Det som kreves er et ekstra skjema for effekt og informasjon om behandling og oppfølging.
Det finnes ingen formelle krav til at en RCT skal inkludere økonomiske evalueringer i Norge og vi mangler gode retningslinjer for hvordan slike analyser skal gjennomføres i praksis. Vi ønsker i denne artikkelen å gi en innføring i hvordan økonomisk evaluering kan bli en naturlig del av en RCT, samt gi en oppsummering av publiserte studier basert på randomiserte forsøk i Norge fram til oktober 2016.
Kost-effektanalyser i randomisert kontrollerte forsøk
Randomiserte kontrollerte forsøk
Når en ny teknologi skal evalueres, benytter klinikere ofte en RCT som design for studien hvor pasienter med visse kjennetegn (inklusjonskriterier) ved hjelp av loddtrekning (randomisering) blir behandlet med den nye teknologien, eller med standard behandling (dagens praksis). I en pragmatisk RCT evaluerer man hvordan den nye teknologien vil fungere hvis den erstatter standard behandling. For å sikre at resultatene er generaliserbare ønsker man få eksklusjonskriterier. Hovedendepunktet er som regel et klinisk relevant endepunkt, som komplikasjonsrate, tilbakefall eller et sykdomsspesifikt mål.
Kost-effektanalyse
I en kost-effektanalyse estimeres ressursbruken (kostnader) og helseeffekten (kvalitetsjusterte leveår) av både den nye teknologien og dagens (11,13). Målet er å estimere en inkrementell kost-effekt brøk (ICER) som tolkes som kostnaden per ekstra effekt. Det finnes ulike typer evalueringer avhengig av hvilket effektmål man bruker (monetære eller ikke-monetære effektmål). Når både kostnadene og effektene er estimert, kan man beregne ICER representert ved:
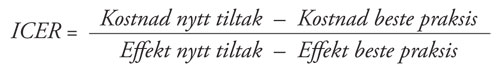
ICER kan også illustreres i et kostnadseffektivitetsplan, som vist i figur 1.
Dagens beste praksis er referansebehandlingen og plasseres i skjæringspunktet mellom aksene i figur1. Alle resultatene (punktene) i kost-effektplanet tolkes som inkrementelle differanser fra beste praksis. Den vertikale linjen representerer kostnadsdifferansen (i forhold til beste praksis) og den horisontale linjen representerer effektdifferansen. Når kostnadene og effektene medfører at det nye tiltaket tilpasser seg i B, da er det nye tiltaket en dominerende strategi, siden den medfører både lavere kostnader og høyere effekt. Hvis det nye tiltaket er mindre effektivt og kostet mer (lokalisert i C), vil vi si at det nye tiltaket er dominert av beste praksis. Hvis den nye teknologien har høyere kostnader og bedre effekt enn dagens praksis, vil vi ha et resultat gitt ved A. Hvis det nye tiltaket koster mindre og har mindre effekt vil vi ha et resultat gitt ved D. Når et alternativ enten er i A eller D, vil det være en avveining om vi skal innføre tiltaket (11,13). Avveiningen avhenger av grenseverdien for en helsegevinst (QALY eller vunnet leveår). Det finnes ingen konsensus om betalingsvilligheten per QALYs (statistiske leveår) i Norge, men en mye sitert og benyttet grenseverdi NOK 500.000 (2005-verdier) (14).
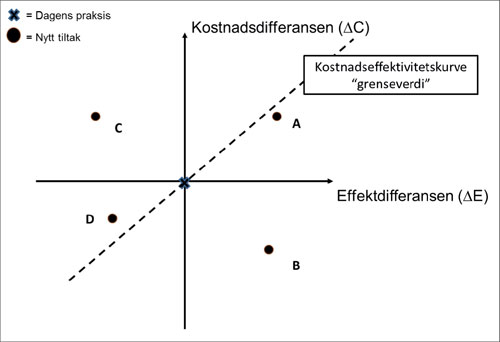
Figur 1: Kostnadseffektivitetsplan*
*Dagens beste praksis er plassert i origo (rødt punkt). Det er 4 områder i dette planet, illustrert ved 4 punkter A til D. Hvis det nye tiltaket koster mer og er mer effektivt, vil det plassere seg i A. For B er det nye tiltaket en dominerende strategi (koster mindre og mer effektivt), i C blir det nye tiltaket dominert av beste praksis (koster mer og er mindre effektivt), mens en situasjon som i D, vil det nye tiltaket være mindre kostbart, men er også mindre effektivt. Justeres i korrekturen.
Punktene, som angitt i Figur 2, er et gjennomsnittstall. For å være sikker på hva som skal anbefales, må vi vurdere usikkerheten i punktestimatene. Usikkerheten rapporteres ofte som sannsynligheten for at konklusjonen er riktig estimert, beregnet ved hjelp av Bootstrapping. Bootstrap er en metode hvor man trekker nye utvalg (1000 eller 10 000), med tilbakelegging. For hvert nytt utvalg estimerer man gjennomsnittlige kostnader, helseeffekter og ICER som på det originale utvalget. Resultatene av de nye utvalgene plottes i en tilsvarende figur som Figur 1 (1000 eller 10 000 nye ICERs), og kan i tillegg representeres ved en «cost-effectiveness acceptability curve» (CEAC). CEAC tolkes som sannsynligheten for at det nye tiltaket er kostnadseffektivt, gitt ulike nivåer på grenseverdien (15).
Pasientforløp
Utgangspunktet for en god evaluering, er en forståelse av pasientforløp, og hvordan en ny teknologi kan tenkes å endre forløpene. Figur 2 er en illustrasjon på et tenkt pasientforløp for personer med hoftebrudd.
En pasient får et brudd mens hun er hjemme, og må transporteres til sykehuset (bil eller ambulanse). Hun behandles, og etter endt behandling blir personen skrevet ut til hjemmet. For noen personer oppstår det komplikasjoner noe som krever at det gjennomføres reoperasjoner på sykehuset. Det kan tenkes at en reoperasjon er så krevende at det er behov for opptrening på sykehjem før man kan reise hjem og klare seg selv.
Kostnadene ved dette forløpet vil bestå av all behandling, reoperasjoner, rehabilitering, oppfølging i hjemmet, medikamentell behandling og transport. Hvis en ny operasjonsmetode blir tilgjengelig vil det, gitt at det er noen helseeffekt, endre pasientforløpet. Det er denne endringen vi ønsker å måle konsekvensen av i form av kostnader og helseeffekter.
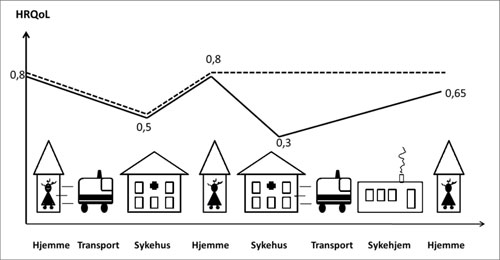
Figur 2: Eksempel på ulike pasientforløp for hoftebrudd illustrert ved bevegelser mellom hjem og behandlingsinstitusjoner, samt transport. Helserelatert livskvalitet for hele pasientforløpet er illustrert for de to intervensjonsgruppene.
Måling av helseeffekt
Helseeffekt kan måles på ulike måter: forventet levetid, unngåtte komplikasjoner, unngåtte reinnleggelser, liggetid eller sykdomsspesifikke mål. Vi fokuserer kun på QALYs da dette er det anbefalte effektmålet i Norge (14). QALYs er et mål som kombinerer levetid med helserelatert livskvalitet (HRQoL). HRQo L er gitt på en skala fra 0 (død) til 1 (perfekt helse).
For å måle HRQoL, må pasientene svare på et generiske måleinstrument (EQ-5D, SF-36, 15D, HUI 3, AQOL). Dette er preferansebasert mål, det vil si at det til hver helsetilstand er tillagt en vekt. Ta for eksempel EQ-5D-5L. EQ-5D-5L har fem dimensjoner (gange, personlig stell, vanlige gjøremål, smerte/ubehag og angst/depresjon). Innen hver dimensjon er det fem nivåer, fra ingen problemer til store problemer. Det å ha ingen problemer gir verdien 1, noen problem gir verdien 2 og så videre. En helsetilstand er en oppsummering av hva respondentene har krysset av på for hver av de fem dimensjonene for helse og sier noe om helsen til en pasient (for eksempel 1,1,1,1,1 = ingen problemer i noen av dimensjonene). Preferansene kommer til uttrykk ved at reduksjonen fra ingen til noen problemer for dimensjonen gange, kan være forskjellig fra ingen til noen problemer for dimensjonen smerte/ubehag. Disse endringene innen hver dimensjon og nivå kalles vekter. Vektene som anvendes, er basert på preferanser i en generell frisk befolkning (11–13). Disse vektene (algoritmene) er lett tilgjengelige fra universiteter og organisasjoner som har utviklet algoritmene.
Selv om konseptet QALYs og HRQoL kan oppfattes som abstrakte begreper, er de til dels enkle å måle; og det finnes ingen gode alternativ. Pasienter må kun svare på et generisk spørreskjema ved inklusjon, og ved de samme oppfølginger som ellers er planlagt i studien. Tidspunktene vil avhenge av når man forventer endringer i pasientforløpet: ofte kort tid etter at intervensjonen er avsluttet (dager, uker eller noen få måneder) og en eller flere tidspunkt lengre frem i tid for å fange opp langtidskonsekvenser. Estimeringen a QALYs er gitt ved området under den røde og blå kurven gitt i Figur 2. Effekten av den nye teknologien er gitt ved området mellom kurvene.
Kostnader
Helseøkonomer og klinikere bør sammen diskutere hvilke kostnadskomponenter som er relevant å inkludere i analysen. Kostnadsestimeringen består av tre deler: Identifisering, kvantifisering og verdsetting. Identifisering omhandler hvilke ressurser som skal inkluderes i analysene, kvantifisering i hvilke enheter ressursene skal telles og hvor man skal finne informasjon om ressursbruk, og verdsetting om estimering av enhetskostnader for de enkelte ressursene.
Identifisering
Ved identifisering velger man perspektiv for analysen: sykehus-, kommune-, helsetjeneste- eller samfunnsperspektivet. De anbefalte perspektivene er helsetjenesteperspektiv og samfunnsperspektiv. Perspektivet påvirker hvilke ressurser som inkluderes. Man vil for eksempel i et helsetjenesteperspektiv ikke inkludere informasjon om sykedager, mens dette er viktig å inkludere i et samfunnsøkonomisk perspektiv.
Ressurser man inkluderer i et helsetjenesteperspektiv er knyttet til pasientforløpet, og kan inkludere alt fra diagnostikk og behandling til rehabilitering og oppfølging, og omfatter tjenester tilbudt i spesialist- og primærhelsetjenesten. Resurser i et samfunnsperspektiv kan i tillegg inkludere kostnader for andre sektorer (skole, frivillighet, fengselsvesen, sosialomsorg), private kostnader (reisekostnader) og produksjonstap (sykedager).
Kvantifisering
Kvantifisering handler om hvilke enheter man teller kostnadene i (som antall dager, antall timer og antall besøk), og hvordan man kan finne informasjon om ressursbruk. I en RCT som gjennomføres på et sykehus, vil man kunne få tilgang til behandlingsinformasjon via journalsystemet (antall minutter på operasjonsstua, antall røntgen og antall liggedager). Samtidig kan det være behov for å opprette egne registreringer i studien. Hvis to operasjonsprosedyrer sammenliknes, kan det tenkes at journalsystemet ikke fanger opp viktige forskjeller i behandlingen, som bruk av utstyr og antall personer på operasjonsstua. Da må dette registreres særskilt. Ønsker man informasjon om bruk av helsetjenester utover den organisasjonen man tilhører, samles dette ofte inn via spørreskjemaer, men kan også hentes ut fra offentlige registre, som Norsk Pasientregister (16). Tidligere har journaler og spørreskjema vært mest vanlig, men i framtiden håper vi at de nasjonale registrene skal bli av en sånn kvalitet og tilgjengelighet at de kan benyttes. Fordelen ved å benytte registre er at man ikke behøver å belaste pasienter med unødvendige spørsmål og informasjonen blir komplett for alle inkluderte pasienter.
Verdsetting
Verdsetting består av å finne enhetskostnaden til ressursene man har identifisert og kvantifisert: hva er enhetskostnaden for en dag innlagt på medisinsk avdeling eller 30 minutter fysioterapi? I teorien ønsker vi å benytte oss av alternativkostnadsprinsippet. Alternativkostnaden er gitt ved verdien av en ressurs i beste alternative anvendelse. Det betyr at verdien av en time legekonsultasjon benyttet i en RCT vurderes til lønnen legen ville fått i det arbeidet hun/han hadde utført hvis hun/han ikke hadde deltatt i den relevante studien. I praksis benyttes ofte enklere tilnærminger, slik som gjennomsnittskostnader, finansieringssystemet og utsalgspriser. Eksempler på verdsetting blir bruk av DRG-vekter for behandling på sykehus og apotekenes utsalgspris (AUP) for verdsetting av legemidler (16, 17). Verdsetting er krevende da det ikke finnes noen klare retningslinjer for hvordan dette skal gjøres. Det er derfor viktig at man rapporterer både antall enheter og hvilken enhetskostnad som er lagt til grunn for estimering av kostnader. Dette sikrer transparens i analysene.
Kost-effektanalyser i Norge
Vi gjennomførte et pragmatisk søk etter studier med følge kriterier: Analysene er gjennomført i en norsk setting, designet som et RCT, inkludere kostnader og helseeffekter, samt publisert i et vitenskapelig internasjonalt tidsskrift med fagfellevurdering. Dette resulterte i 13 kost-effektanalyser, publisert i perioden 2002 til 2016. Antall deltagere varierte fra 46 deltagere i hverdagsrehabiliteringsstudien (18) til 1110 deltagere i organisering av fødselshjelp (19). Tidsperspektivet på analysene varierte fra første sykehusopphold (19, 20) til fem år (21). De fleste studier har en oppfølging på mellom et og to år (22–29). Analysene omfatter flere sykdomsområder (fra fødselshjelp til ortopedi) (19,26), og er gjennomført på ulike nivåer av tjenesten (kommune, sykehus eller begge nivåer), for detaljer se Tabell 1.
Helseeffekt
Av de 13 studiene, hadde 8 av studiene inkludert minst ett generisk mål for helserelatert livskvalitet. Av instrumentene som ble benyttet var EQ-5D det mest vanlige og ble inkludert i fem studier (24–26,28,29), 15D ble inkludert i 3 av analysene (23,27,30), mens SF-6D ble inkludert sammen med EQ-5D i to studier (24,25).
I de resterende studiene, ble det benyttet sykdomsspesifikke mål i tre av studiene (18, 19, 21), mens de to siste studiene hadde liggetid i dager (20) og andelen tilbake til arbeid som effektmål (22).
Kostnader
Blant de inkluderte studiene hadde seks av studiene et samfunnsperspektiv i tillegg til et helsetjenestepespektiv (22,23,25,27,29,30). I to av studiene var analysene gjort ut fra et sykehusperspektiv (19–20), mens kommuneperspektivet lå til grunn for analysen til Kjærstad og Tuntland (2016) (18). I de resterende studiene, inkluderte man kostnader for heletjenesten (21,26,28).
Forfattere |
Pasientpopulasjon |
Sammenlikning |
Analyse, effektmål |
Perspektiv |
Tid |
|---|---|---|---|---|---|
Skouen et al. (2002) (22) |
Kroniske ryggplager (n=195) |
Tverrfaglig trening versus vanlig oppfølging |
CBA |
Samfunn |
26 md |
Fjalestad et al. (2010) (23) |
Skulderbrudd (n=50) |
Kirurgis versus konservativ behandling |
CUA 15D |
Helse og samfunn |
1 år |
Lønne et al. (2015) (24) |
Rygg (lumbal spinal stenose) (n=96) |
X-stop versus minimal invasive decompresjon |
CUA EQ-5D |
Helse og samfunn |
2 år |
Johnsen et al. (2014) (25) |
Kroniske ryggplager (n=173) |
Total plate erstatning versus tverrfaglig rehabilitering |
CUA EQ-5D og SF-6D |
Helse og samfunn |
2 år |
Waaler et al. (2011) (26) |
Hoftebrudd (n=222) |
Hemiprotese versus skruer |
CUA EQ-5D |
Helse |
2 år |
Bernitz et al. (2012) (19) |
Fødende (n=1110) |
Jordmorstyrt enhet versus standard enhet |
CEA unngåtte hendelser |
Sykehus |
Første opphold |
Prestmo et al. (2015) (28) |
Hoftebrudd (n=1077) |
Omfattende geriatrisk oppfølging versus ortopedisk avdeling |
CUA EQ-5D |
Helse |
1 år |
Larsen et al. (2016) (30) |
Psoriasis (n=169) |
Motiverende intervju versus ingen oppfølging |
CUA 15D |
Helse og samfunn |
6 md |
Bøhmer et al. (2014) (27) |
Hjerteinfarkt (n=266) |
Tidlig versus sen invasiv oppfølging |
CUA 15D |
Helse og samfunn |
1 år |
Kjerstad og Tuntland (2016) (18) |
Eldre hjemme-boende (n=46) |
Hverdagsrehabilitering versus vanlig oppfølging |
CEA sykdoms-spesifikt mål |
Helse for kom-munen |
9 md |
Andersen et al. (2015) (20) |
Akutt koronar-syndrom (n=399) |
Utskrivelse samme dag versus standard forløp |
CEA liggetid |
Sykehus |
Første opphold |
Werner et al. (2016) (29) |
Subakutt og kroniske ryggplager (n=216) |
Kognitiv opplæring versus standard behandling I primærhe-lsetjenesten |
CUA EQ-5D |
Helse og samfunn |
1 år |
Andelic et al. (2014) (21) |
Alvorlig hjerneskade (n=59) |
Kontinuerlig rehabilit-ering versus standard behandling |
CEA sykdoms-spesifikt mål |
Helse |
5 år |
CUA = cost-utility analysis, CEA = cost-effectiveness analysis, CBA = cost benefit-analysis
EQ-5D = EuroQol skjema med 5 dimensjoner, 15D = Harry Sintonens skjema med 15 dimensjoner,
SF-6D = Short Form (36) Health Survey
De fleste av studiene benyttet pasientjournaler (n=9) som grunnlag for kvantifisering av kostnader (19–21,23–28). I tre av disse ble journalene kombinert med skjema (23,26, 27), i to ble journalene kombinert med pasientdagbøker (24,25) og i to kombinert med registre (24,28). I to ble det kun benyttet skjemaer (29,30), i en studie ble det utviklet skjemaer til utfylling for helsearbeidere (18), mens det i en bare ble benyttet registerinformasjon (22).
Kost-effektanalyser
Alle inkluderte analyser (unntatt Skouen) rapporterte inkrementelle kostnader og effekter, og med unntak av tre analyse (20,22,29) ble ICER rapportert. Med unntak av to studier inkluderte alle sensitivitetsanalyser hvor resultatet ble rapportert i et kost-effekt plan (18,19, 21,23–30). I seks av studiene ble også CEAC (cost-effectiveness acceptability curve) rapportert (21,24,25,28–30). Resultatene i den siste studien ble rapportert i kroner siden effekten ble målt i sykefravær (22).
Kommentar
I 2005 tok Terje P Hagen, sammen med kolleger ved Avdeling for helseledelse og helseøkonomi, Grete Botten, Tor Iversen og Ivar S. Kristiansen, samt Jørgen J. Jørgensen ved Oslo Universitetssykehus initiativet til å opprette et nettverk innen Helse Sør-Øst med intensjon om å bidra til flere kost-effektanalyser i kliniske studier. Helse Sør-Øst bevilget penger til dette nettverket. Et samarbeid mellom helseøkonomer og klinikere er avgjørende for at dette arbeidet kunne starte opp, og flere av arbeidene inkludert i denne analysen er resultat av dette initiativet.
Oppsummeringen av de norske studiene viser at det i de fleste analysene var inkludert et generisk mål på helse, samt at analysene var gjennomført ut fra standard metoder (11–13). For klinikere som vurderer å inkludere en kost-effektanalyse, kan disse studiene fungere som gode maler og det kan være en god ide å kontakte forskerne direkte for å få innspill. Enhver studie har sitt særpreg, så det er naturlig at noe må endres.
Det er et ønske om at helseeffekten skal måles med et generisk mål (slik som EQ-5D) slik at nye tiltak kan vurderes på tvers av sektoren. Samtidig, kan det også være meningsfylt å ha andre utfallsmål som unngåtte tilfeller eller mer sykdomsspesifikke mål hvis hovedhensikten er endring i behand ling innen en spesifikk sykdom. Mål som unngåtte komplikasjoner og reinnleggelser har også stor klinisk relevans.
En av de største svakhetene ved kost-effektanalyser i randomiserte forsøk er at de har en kortere tidshorisont enn modellbaserte økonomiske evalueringer (som ofte har livstidsperspektiv). Som tommelfingerregel så bør en RCT-basert økonomisk evaluering vare like lenge som forventet forskjell i kostnader (elevated costs) og effekter forekommer (12).
I kliniske studier er det ofte inklusjonskriterier, dette kan være problematisk med hensyn til hvor generelle funnene er og hvordan resultatene kan brukes i anbefaling av utforming av guidelines. Jo videre inklusjonskriteriene er, desto enklere kan det være å gi generelle anbefalinger. Studier gjennomført i en institusjon, som et sykehus, kan medføre at enhetskostnadene ikke er sammenliknbare for andre sykehus. I slike situasjoner er det viktig at både antall enheter (som minutter på operasjonsstua og antall liggedøgn) og enhetsprisen oppgis. Da kan andre enheter enklere vurdere hva totalkostnaden vil bli for deres institusjon.
Det er et stort krav til transparens i denne typen analyser, hva er målt, når og hvordan. Alle forutsetninger som er lagt til grunn for analysene, skal grundig rapporteres. Ofte er det et problem at kravene til publisering krever at mye må utelates. Da er det viktig at nødvendig informasjonen gjøres tilgjengelig ved et online appendiks.
For at kost-effektanalyser skal kunne brukes i beslutninger, krever det at relevante data for kostander og effekt samles inn og at adekvate metoder anvendes for analyser. Per i dag, ligger den største barrieren for å få gode sammenliknbare studier, på hvilke enhetskostnader som skal legges til grunn. Hvilke prinsipper skal legges til grunn for vurderingen av en time praktisk bistand, hjemmesykepleie eller fysioterapi? Skal kun direkte arbeidstid legges til grunn? Hva med reise til og fra hjemmet og skal overhead inkluderes som et påslag? Hvis man benytter finansieringssystemet som et estimat på kostnader, hvordan skal systemet anvendes? Dette er noe offentlige myndigheter bør ta tak i for å sikre at analysene fremover gjøres etter sammenliknbare prinsipper.
Kost-effektanalyser er fortsatt et ganske nytt område i Norge. Det har i de senere årene vært gjennomført mange analyser i forbindelse med innføring av nye legemidler, samt evalueringer ved Kunnskapssenteret (FHI). Vi mener det er et stort potensiale for slike analyser i forbindelse med klinisk randomiserte forsøk. Dette bør utnyttes i større grad og flere gode norske studier kan vise hvordan dette kan gjøres i praksis.
Litteratur
NOU 1987:23. Retningslinjer for prioriteringer innen norsk helsetjeneste.
NOU 1997:18. Prioritering på ny.
Blåreseptforskriften. 2007:814. Forskrift om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften).
Meld. St. 16 (2010–2011). Nasjonal helse- og omsorgsplan (2011–2015).
Meld. St.10 (2012–2013). God kvalitet – trygge tjenester – Kvalitet og pasientsikkerhet I helse- og omsorgstjenesten.
H Meld. St. 28 (2014–2015). Legemiddelmeldingen – Riktig bruk – bedre helse.
Meld. St. 34 (2015–2016). Verdier i pasientens helsetjeneste – Melding om prioritering.
Helsedirektoratet. Om systemet. Nettside: https://nyemetoder.no/om-systemet (lest 7.11 2016).
Nasjonalt råd for prioritering i helse- og omsorgstjenesten. Mandat. Hentet fra: http://www.prioritering.no/r %C3 %A5det/mandat (lest 12.11.2016)
Briggs A, Claxton K og Sculpher M.J. Decision modelling for health economic Evaluation. Oxford: Oxford University Press, 2006.
Drummond MF, Sculpher MJ Torrance GW, O’Brien BJ and Stoddart GL. Methods for the economic evaluation of health care programmes. Oxford: Oxford University Press, 2005.
Glick HA, Doshi JA, Sonnad SS og Polsky DP. Economic evaluation in clinical trials. Oxford: Oxford University Press, 2007.
Olsen, JA. Helseøkonomi: effektivitet og rettferdighet. Oslo: Cappelen Akademiske Forlag, 2006.
Helsedirektoratet. Økonomisk evaluering av helsetiltak – en veileder. Hentet fra: https:// helsedirektoratet.no/Lists/Publikasjoner/Attachments/624/Okonomisk-evaluering-avhelsetiltak-IS-1985.pdf. (lest 12.11.2016)
Fenwick E. A guide to cost-effectiveness acceptability curves. Br J Psychiatry 2005; 187(2):106–8.
Helsedirektoratet. Norsk pasientregister (NPR). Hentet fra: https://helsedirektoratet.no/norsk-pasientregister-npr (lest 12.11.2016)
Statens Legemiddelverk. Maksimalpris. Hentet fra: https://legemiddelverket.no/refusjonog-pris/pris-pa-legemidler/maksimalpris#fastsettelse-av-maksimalpris (lest 12.11.2016).
Kjerstad E og Tuntland H. Reablement in community-dwelling older adults: a costeffectiveness analysis alongside a randomized controlled trial. Health Econ Rev. 2016;6:15.
Bernitz S, Aas E, Øian P. Economic evaluation of birth care in low-risk women. A comparison between a midwife-led birth unit and a standard obstetric unit within the same hospital in Norway. A randomised controlled trial. Midwifery 2012; 28(5): 591–9.
Andersen JG, Grepperud S, Kløw NE, Johansen O. Effects on length of stay and costs with same-day retransfer to the referring hospitals for patients with acute coronary syndrome after angiography and/or percutaneous coronary intervention. Eur Heart J Acute Cardiovasc Care 2015;5(4):375–380.
Andelic N, Ye J, Tornas S, Roe C, Lu J, Bautz-Holter E, Moger T, Sigurdardottir S, Schanke AK og Aas E. Cost-effectiveness analysis of an early-initiated, continuous chain of rehabilitation after severe traumatic brain injury. J Neurotrauma. 2014;31(14):1313–20.
Skouen JS, Grasdal AL, Haldorsen EM, Ursin H. Cost-effectiveness of a light multidisciplinary treatment program compared to an extensive multidisciplinary treatment program in cronic low back pain patients on long-term sick leave. A randomized controlled study. Spine 2002;27(9):901–9.
Fjalestad T, Hole MØ, Jørgensen JJ, Strømsøe K, Kristiansen IS. Health and cost consequences of surgical versus conservative treatment for a comminuted proximal humeral fracture in elderly patients. Injury 2010;41(6):599–605.
Lønne G1, Johnsen LG, Aas E, Lydersen S, Andresen H, Rønning R, Nygaard ØP. Comparing cost-effectiveness of X-Stop with minimally invasive decompression in lumbar spinal stenosis: a randomized controlled trial. Spine 2015;40(8):514–20.
Johnsen LG, Hellum C, Storheim K, Nygaard ØP, Brox JI, Rossvoll I, Rø M, Andresen H, Lydersen S, Grundnes O, Pedersen M, Leivseth G, Olafsson G, Borgstrôm F og Fritzell P , Cost-effectiveness of total disc replacement versus multidisciplinary rehabilitation in patients with chronic low back pain: A Norwegian multicenter RCT. Spine 2014;39(1):23–32.
Waaler Bjørnelv GM, Frihagen F, Madsen JE, Nordsletten L, Aas E et al. Hemiarthroplasty compared to internal fixation with percutaneous cannulated screws as treatment of displaced femoral neck fractures in the elderly: cost-utility analysis performed alongside a randomized, controlled trial. Osteoporosis Int. 2012;23(6):1711–9.
Bøhmer E, Kristiansen IS, Arnesen H og Halvorsen S. Health and cost consequences of early versus late invasive strategy after thrombolysis for acute myocardial infarction. Eur J Cardiovasc Prev Rehabil 2011;18(5):717–23.
Prestmo A, Hagen G, Sletvold O, Helbostad JL, Thingstad P, Taraldsen K et al. Comprehensive geriatric care for patients with hip fractures: a prospective, randomized controlled trial. Lancet 2015;385(9978):1623–33.
Werner EL, Storheim K, Løchting I, Wisløff T og Grotle M. 2016. Cognitive patient education for low back pain in primary care: a cluster randomized controlled trial and cost-effectiveness analysis. Spine 2016;41(6):455–62.
Larsen MH, Wahl AK, Polesie, ALK, Aas E. Cost-utility analysis of supported selfmanagement with motivational interviewing for patients with psoriasis. Acta Derm Venereol. 2016; 96(5): 664–8.
PhD-kandidat
Intervensjonssenteret,
Oslo universitetssykehus, Rikshospitalet, Postboks 4950 Nydalen, 0424 Oslo
gudrunmw@medisin.uio.no
Førsteamanuensis
Avdeling for helseledelse og helseøkonomi
Intitutt for helse og samfunn, Universitetet i Oslo
Postboks 1089 Blindern, 0318 Oslo
eline.aas@medisin.uio.no
